
陈振跃
![]()
- 教师英文名称: Zhenyue Chen
- 教师拼音名称: chen zhenyue
- 职务: Professor
- 学历: 博士研究生毕业
- 学位: 工学博士学位
- 毕业院校: 北京理工大学
- 学科:物理学
光学
生物医学工程
开通时间:..
最后更新时间:..

荧光成像具有高灵敏度、高特异性,是现代生物科学研究的主要手段之一。然而,宽场荧光对高散射性生物组织(如大脑)成像时分辨率极大降低,且缺少深度信息。扫描荧光成像(如共聚焦、多光子成像)方法虽然可以减少散射的影响,且可以获得深度信息,但是通常受限于成像视场小和扫描速度慢的问题。为了解决上述瓶颈问题,提出了如下的成像方法。
(1)基于多焦点照明高速扫描大视场荧光成像技术
为了实现大视场高空间分辨率高速成像,提出了一种基于声光偏转器(Acousto-optic Deflector, AOD)和分束光栅的大视场多焦点照明(Large-field Multifocal Illumination, LMI)扫描显微成像方法 (Chen and Mc Larney et al., Laser & Photonics Reviews, 2020)(图 1)。通常情况下,AOD虽然可以实现光束的高速扫描,但是受限于小扫描角度(< 3°),无法实现大视场成像。而分光光栅通过产生多级衍射光可以极大压缩扫描角度,因此通过巧妙地结合两种光学元件的优点,可以实现超快超大视场的高分辨率成像效果。该方法作为一种打破传统扫描显微镜瓶颈的通用技术,同样适用于其他扫描成像系统(Chen and Özbek et al., Light Science & Applications, 2020)。
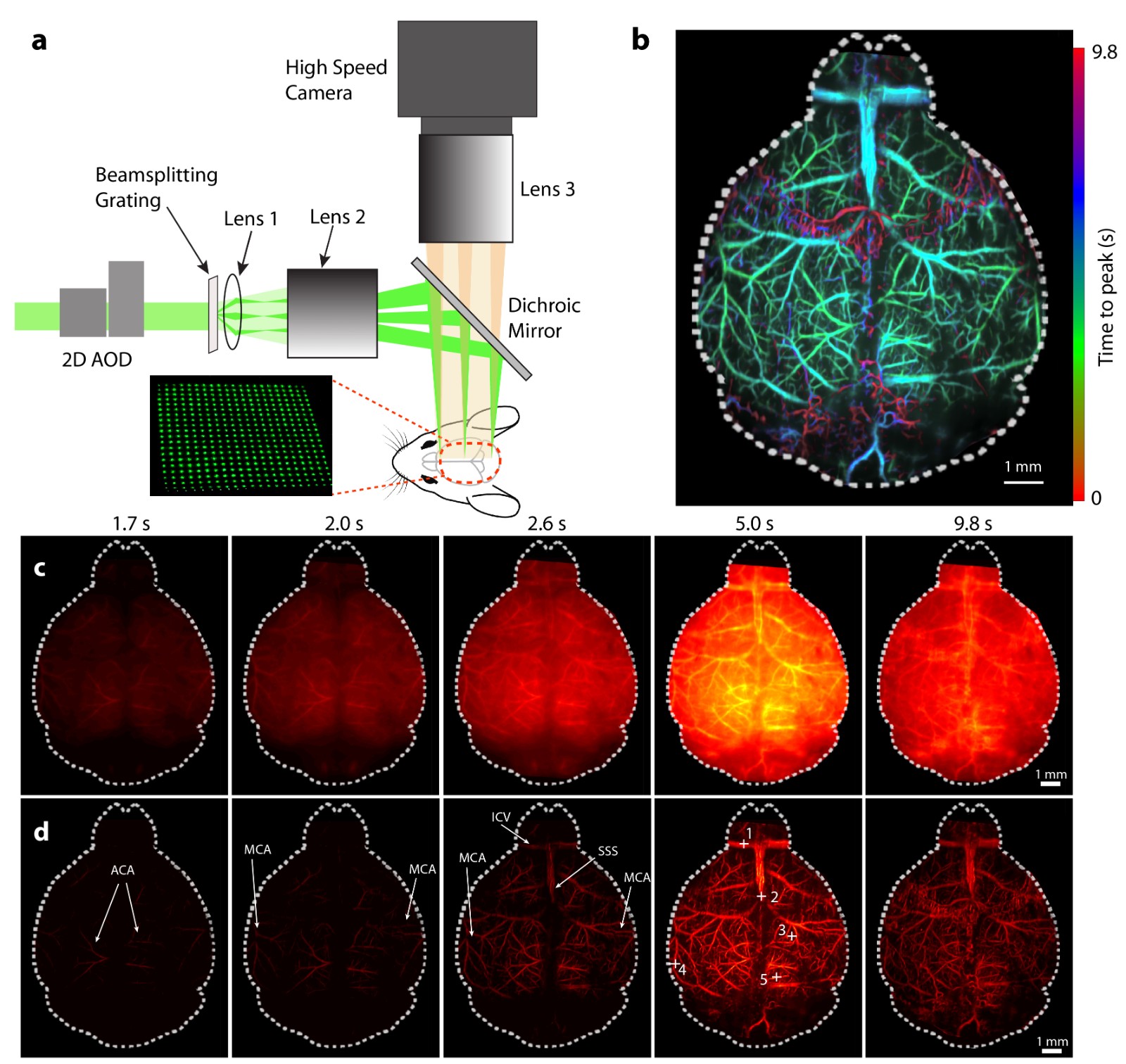
Fig. 1 Large field multifocal illumination fluorescence microscopy and its application in imaging of mouse brain perfusion dynamics.
(2)基于像散深度编码的三维大视场高速荧光成像技术
为了解决传统宽场荧光显微成像不能获取空间深度信息的缺点,同时保持大视场高速成像的优势,提出了基于光学像散深度编码的大视场多焦点三维(3D-LMI)荧光显微成像方法 (Zhou* and Chen* et al., Nature Communications, 2022)。与LMI方法类似,3D-LMI方法使用“晶格”结构光图案投射在待测样本表面上,通过定制的柱透镜实现PSF深度编码,结合后期图像处理提取深度信息,有效编码深度范围约为600μm (图2)。该方法是作为超大视场三维荧光成像的首次探索,用于大脑皮层组织内细胞追踪以及全脑皮层神经元活动相关的研究中。
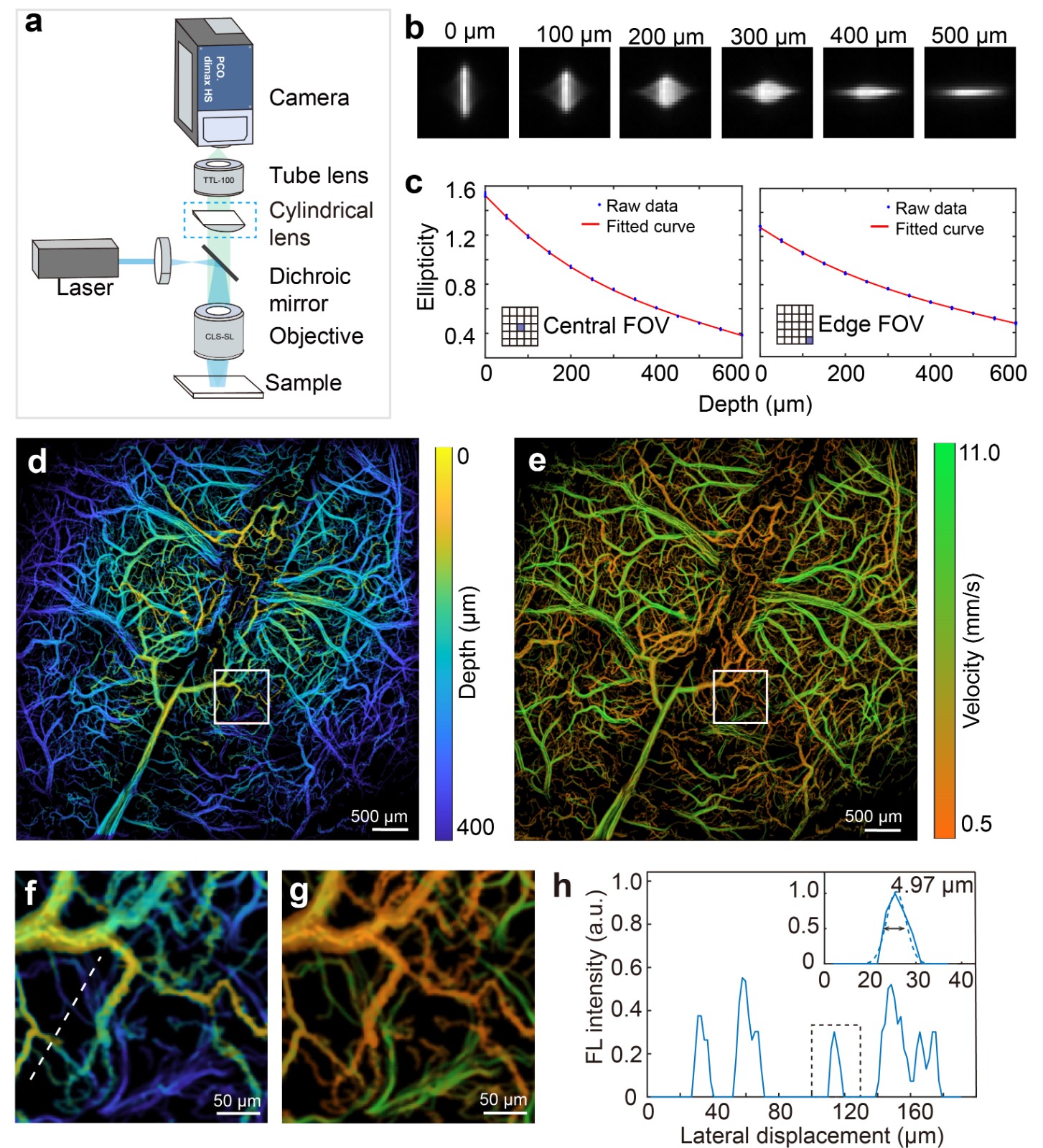
Fig. 2 Three-dimensional large field multifocal illumination fluorescence microscopy.
(3)大视场宽场荧光定位显微成像
由于活体组织中强烈的光信号散射,传统的荧光显微方法需要在颅窗情况下通过长时间扫描才能获得脑血管网络的高分辨率图像。为了在最小侵入情况下快速获取全脑尺度毛细管分辨率下血流速度和流向的实时测量,提出了一种宽场荧光定位显微成像方法 (Chen et al., Optics Lettters, 2020)。该方法基于定位、追踪血液中稀疏分布的荧光微粒,可以在毛细血管水平分辨率(5µm)定量测量经颅血流速度和方向,为非入侵情况下研究脑血管循环和大脑功能提供了一种重要的途径。然而,功能脑成像对荧光标记物提出了更高的要求:1)在体内具有大循环时长;2)能够真实反映血流变化。针对上述要求,进一步提出了基于荧光标记红细胞的功能脑成像方法(图3) (Zhou et al., Chen, Nature Communications, 2020)。通过同时采集神经元荧光钙信号变化,揭示了小鼠整个皮层尺度神经元活动和大脑血流变化的耦合关系,为研究神经血管耦合和神经代谢机制以及神经退行性疾病病理提供了一种有力的工具(图4)。
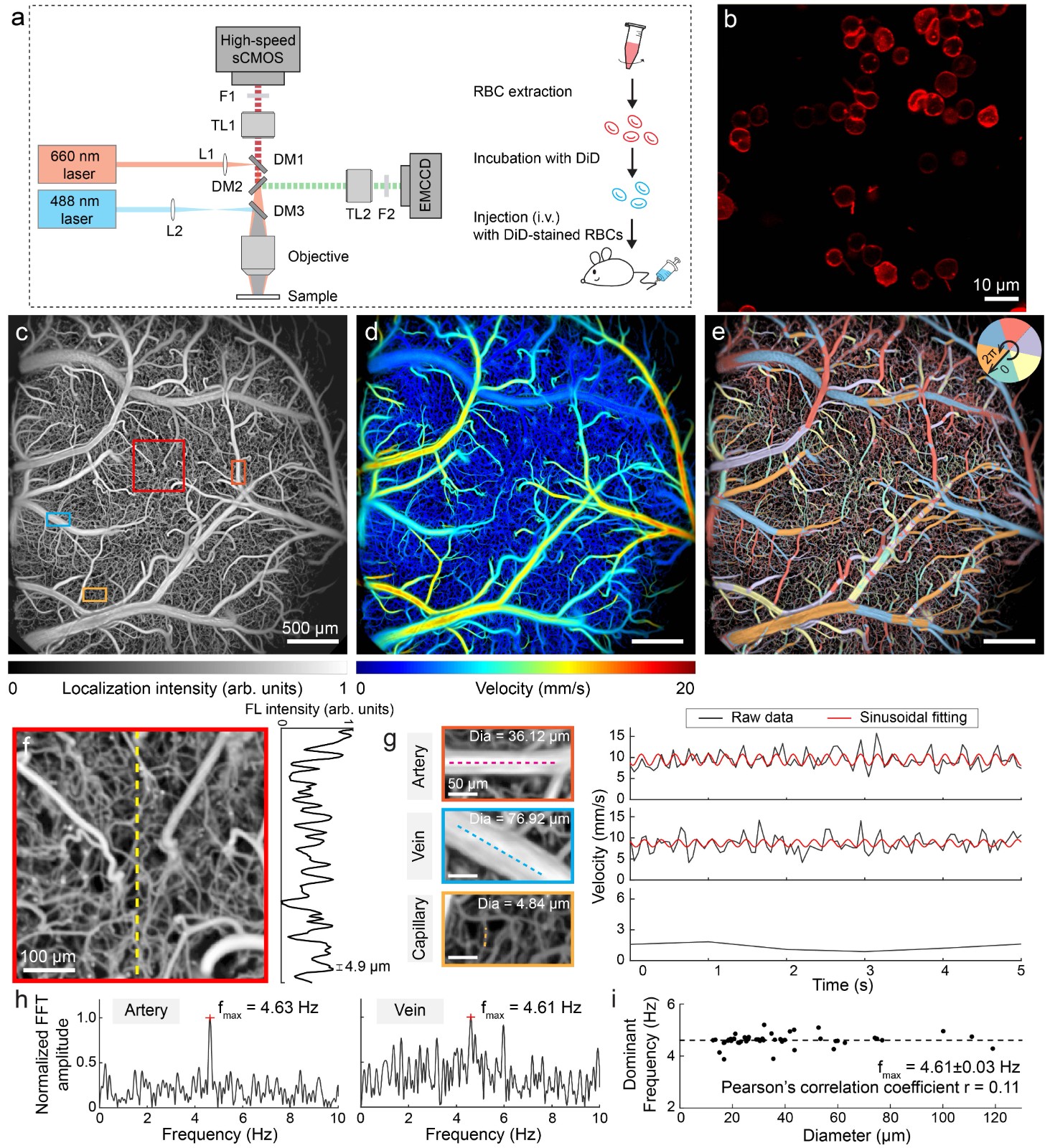
Fig. 3 Whole-cortex high-resolution functionaling neuroimaging with fluorescently labeled RBCs.
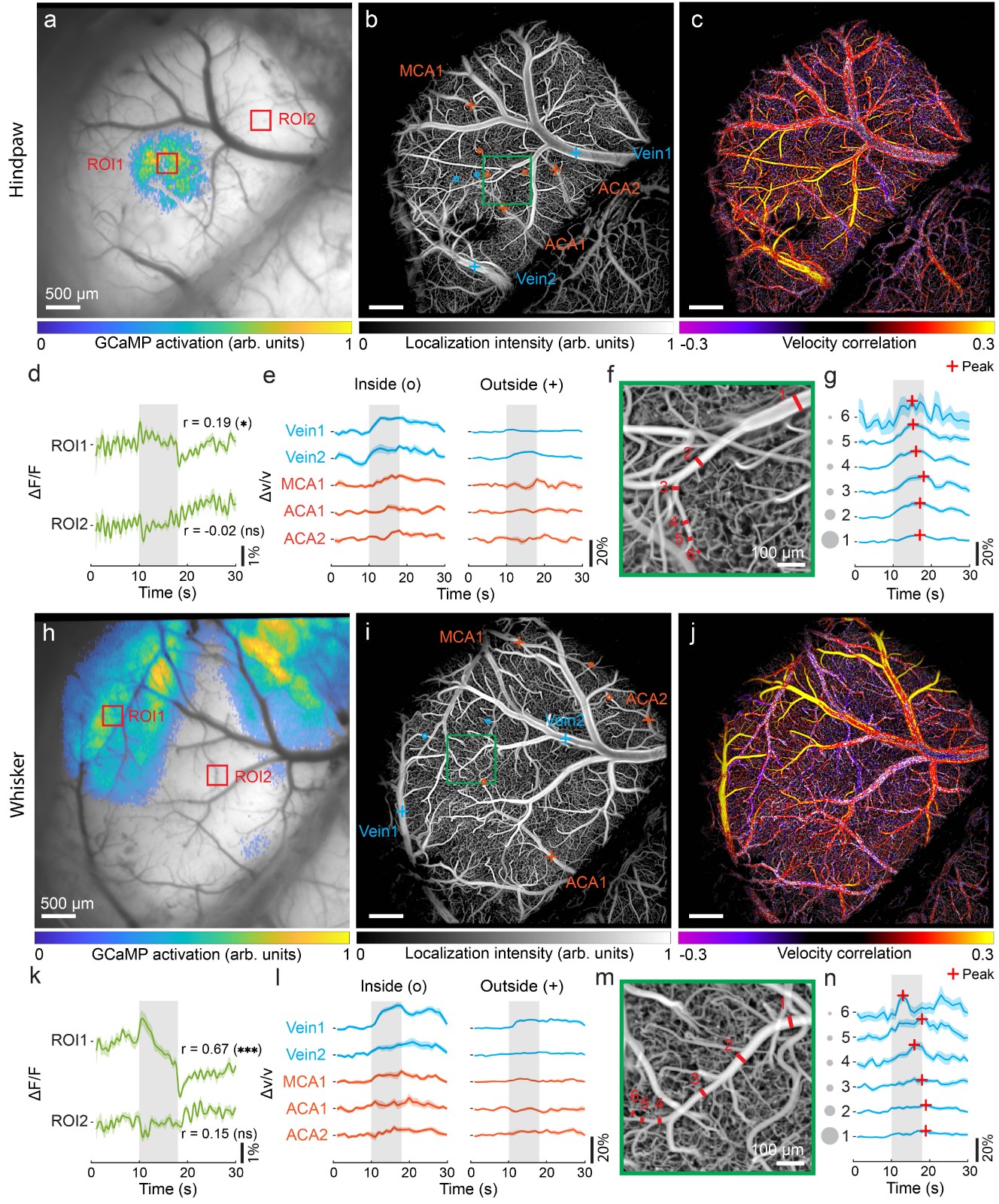
Fig. 4 Co-activation patterns of neuronal calcium signal and induced hemodynamic responses with electrical hindpaw/whisker stimulation paradigm.
References
Z. Chen et al., Transcranial cortex-wide imaging of murine ischemic perfusion with large-field multifocal illumination fluorescence microscopy. 10.1101/2023.11.01.564959 %J bioRxiv, 2023.2011.2001.564959 (2023).
Q. Zhou et al., Three-dimensional wide-field fluorescence microscopy for transcranial mapping of cortical microcirculation. 13, 7969 (2022).
R. Ni, Z. Chen, X. L. Deán-Ben, F. F. Voigt, G. S. Daniel Kirschenbaum, Alessia Villois, Quanyu Zhou, Alessandro Crimi, Paolo Arosio, Roger M. Nitsch, K. Peter R. Nilsson, Adriano Aguzzi, Fritjof Helmchen, Jan Klohs, Daniel Razansky, Multiscale optical and optoacoustic imaging of amyloid-β deposits in mice. Nature Biomedical Engineering, (2022).
Q. Zhou, Z. Chen, J. Robin, X.-L. Deán-Ben, D. J. O. Razansky, Diffuse optical localization imaging for noninvasive deep brain microangiography in the NIR-II window. 8, 796-803 (2021).
Z. Chen, Q. Zhou, J. Robin, D. Razansky, Widefield fluorescence localization microscopy for transcranial imaging of cortical perfusion with capillary resolution. Optics letters 45, 3470-3473 (2020).
Z. Chen, Q. Zhou, J. Rebling, D. Razansky, Cortex‐wide microcirculation mapping with ultrafast large‐field multifocal illumination microscopy. Journal of biophotonics 13, e202000198 (2020).
Z. Chen et al., High‐Speed Large‐Field Multifocal Illumination Fluorescence Microscopy. Laser & photonics reviews 14, 1900070 (2020).
Q. Zhou et al., Cortex-wide transcranial localization microscopy with fluorescently labeled red blood cells. Nature Communications 15, 3526 (2024).
C. Glück et al., Pia-FLOW: Deciphering hemodynamic maps of the pial vascular connectome and its response to arterial occlusion. Proc Natl Acad Sci U S A 121, e2402624121 (2024).



